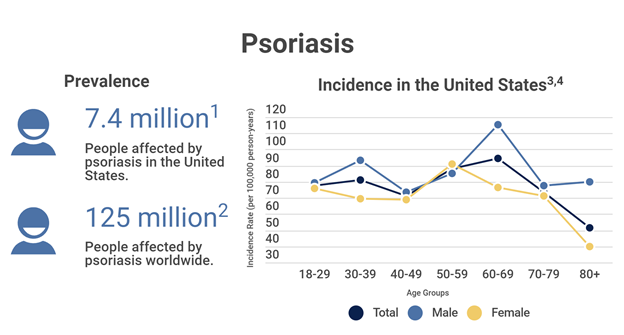
Khoảng 3,2% người từ 20 tuổi trở lên ở Mỹ mắc bệnh vảy nến và tỉ lệ mắc bệnh vẫn không thay đổi trong khoảng 15 năm qua.
Rất nhiều các nghiên cứu đã được thực hiện nhằm tìm hiểu sinh lý bệnh của căn bệnh da mạn tính này. Từ đó phát triển thêm các liệu phát miễn dịch nhắm trúng đích dựa trên sự ức chế các cytokine tiền viêm có tham gia trong quá trình hình thành các mảng vảy nến như TNF-α, IL-17A, IL-12 và IL-23.
Theo đó, trên thị trường thuốc sinh học hiện có các thuốc sau điều trị vảy nến mảng: 4 thuốc ức chế TNF-α (adalimumab, certolizumab pegol, etanercept và infliximab), 3 thuốc ức chế IL-17 (brodalumab, ixekizumab và secukinumab), 3 thuốc ức chế IL-23 (guselkumab, risankizumab và tildrakizumab) và 1 thuốc ức chế đồng thời IL-12 và IL-23 (ustekinumab).
Tất cả các thuốc trên đều đã được FDA chứng nhận về độ an toàn và hiệu quả trong điều trị vảy nến mảng. Gần một nửa bệnh nhân điều trị bằng các liệu pháp nhắm trúng đích đạt được tình trạng sạch hoàn toàn sang thương da.
Vai trò của IL-23 trong Vảy nến
Vai trò chủ chốt của IL-23 trong vảy nến đã được phát hiện khi con người bắt đầu hiểu về cơ chế sinh bệnh của vảy nến. IL-23 được tìm thấy vào năm 2000, là một cytokine có cấu trúc dị dimer, có cùng chung 2 tiểu đơn vị là p19 và p40 với IL-12 (một loại cytokine khác có vai trò trong cơ chế sinh bệnh vảy nến).
IL-12 có chứa 2 tiểu đơn vị p40 và p35, đã được chứng minh là có vai trò trong việc hình thành các tế bào T giúp đỡ (Th) típ 1 cần cho đáp ứng miễn dịch qua trung gian tế bào. Khi phân tích, người ta thấy rằng da của các bệnh nhân bị vảy nến có nồng độ mRNA của p19 và p40 cao hơn những người không bị. Ngoài ra, việc tiêm IL-23 vào trong da chuột có thể dẫn đến việc hình thành sang thương vảy nến.
TS. BS. Anthony Fernandez, nhà nghiên cứu lâm sàng và bác sĩ da liễu của phòng khám Cleveland (Mỹ) cho biết “IL-23 đã được chứng minh là một cytokine chủ chốt trong quá trình sinh bệnh vảy nến vì IL-23 không chỉ cần cho giai đoạn biệt hóa cuối cùng của tế bào Th17 mà còn cần cho sự tồn tại của các tế bào này.”
Một khi được kích hoạt, các tế bào Th17 sẽ sản xuất ra các cytokine tiền viêm chủ đạo như IL-17A, tạo ra dòng thác viêm tự phát. Nghiên cứu cũng chứng minh rằng các tế bào Th17 đồng thời cũng tiết ra IL-22, IL-21 và TNF-α. Các cytokine này sau đó lại tiếp tục góp phần trong quá trình hình thành mảng vảy nến.
Thuốc kháng IL-23 trong điều trị Vảy nến
TS Fernandez cho biết “ Việc ức chế IL-23 có thể có ích trong quá trình điều trị vảy nến vì chúng ta biết rằng IL-23 rất quan trọng đối với sự tồn tại của tế bào Th17. Khi ta ức chế IL-23, số lượng tế bào Th17 gây bệnh cũng sẽ giảm theo thời gian. Việc này giúp cho ta có thể kiểm soát được vảy nến lâu dài hơn.”
Ustekinumab, thuốc sinh học đầu tiên tác động đồng thời vào IL-23 và IL-12 thông qua tiểu đơn vị chung p40, được FDA chấp thuận cho dùng trong điều trị vảy nến mảng vừa và nặng từ năm 2009. Đến nay, thuốc này vẫn được sử dụng trong điều trị vảy nến. Việc phát triển các thuốc tác động vào IL-23 để điều trị vảy nến không những vì IL-23 có vai trò trung tâm chủ đạo trong quá trình sinh bệnh mà còn vì bảo đảm tính an toàn khi không can thiệp đáp ứng của Th1 thông qua trung gian IL-12.
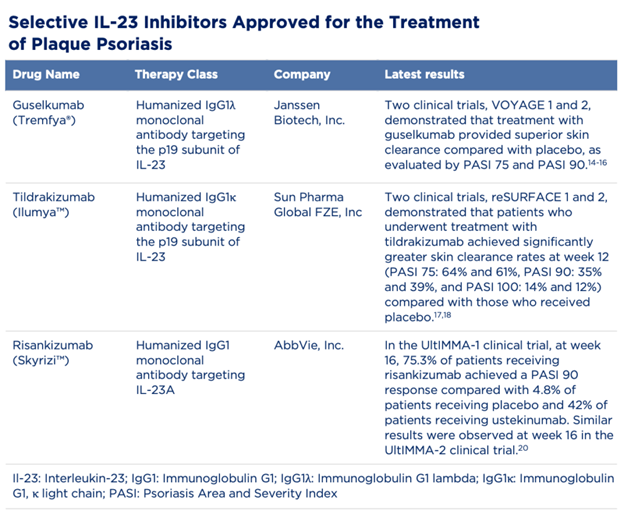
Ba thuốc ức chế IL-23 hiện đang được chấp thuận trong điều trị vảy nến mảng là : guselkumab, risankizumab và tildrakizumab.
Guselkumab
Guselkumab là kháng thể đơn dòng của người, có khả năng gắn vào tiểu đơn vị p19 của IL-23. Guselkumab là thuốc ức chế IL-23 đầu tiên được FDA chấp thuận để sử dụng trong điều trị vảy nến vừa và nặng ở người trưởng thành, những người có chỉ định dùng liệu pháp hệ thống và liệu pháp ánh sáng để điều trị.
Kháng thể đơn dòng được chấp thuận vào năm 2017 nhờ kết quả của 2 thử nghiệm lâm sàng, mù đôi, có nhóm chứng trên các bệnh nhân vảy nến vừa và nặng ở Mỹ, Châu Âu, Canada, Úc, Nga, Hàn Quốc và Đài Loan. Gần đây nhất vào tháng 7/2020, Guselkumab được FDA chấp thuận trong điều trị vảy nến khớp đang hoạt động ở người trưởng thành.
Hai thử nghiệm lâm sàng (VOYAGE 1 [ClinicalTrials.gov Identifier: NCT02207231] và VOYAGE 2 [ClinicalTrials.gov Identifier: NCT02207244]) so sánh hiệu quả điều trị giữa các liệu trình sau: (1) dùng Guselkumab 100mg ở các tuần 0, 4 và mỗi 8 tuần sau đó, (2) dùng giả dược, sau đó sử dụng Guselkumab ở tuần thứ 16 và (3) dùng Adalimumab 80mg ở tuần 0, 40mg ở tuần 1 và mỗi 2 tuần sau đó.
Các thử nghiệm trên cho thấy việc điều trị bằng Guselkumab giúp đem lại hiệu quả sạch sang thương tốt hơn các thuốc khác dựa vào việc đánh giá theo PASI 75 và PASI 90.
Guselkumab được điều chế dưới dạng thuốc tiêm dưới da với liều lượng 100mg/mL chứa trong các bơm tiêm dùng 1 lần, bơm tiêm dùng lại và bơm tiêm tự động. Hướng dẫn kê toa (prescribing information _ PI) của Guselkumab cho thấy liệu trình tiêm thuốc gồm 1 liều tại các tuần 0, tuần 4 và mỗi 8 tuần sau đó.
Hướng dẫn kê toa cũng cảnh báo về sự xuất hiện các phản ứng quá mẫn có thể xảy ra, về việc tăng nguy cơ nhiễm trùng và đồng thời khuyến nghị nên kiểm tra lao trước khi bắt đầu dùng thuốc.
Trong các thử nghiệm lâm sàng trên bệnh nhân vảy nến mảng, những bệnh nhân điều trị bằng Guselkumab có tăng nhẹ tỉ lệ nhiễm trùng (23%) khi so với nhóm dùng giả dược (21%), nhưng tỉ lệ nhiễm trùng nặng ở cả 2 nhóm đều rất thấp (≤0,2%). Các tác dụng phụ thường gặp nhất trong 16 tuần là nhiễm trùng đường hô hấp trên (14,3%), đau đầu (4,6%), phản ứng tại chỗ tiêm (4,5%) và đau khớp (2,7%).
Tildrakizumab
Tildrakizumab là kháng thể đơn dòng được nhân bản từ người, ức chế chọn lọc vào tiểu đơn vị p19 của IL-23, là thuốc ức chế IL-23 thứ 2 được FDA đồng thuận sử dụng trong điều trị vảy nến vừa và nặng, trên những người phải điều trị bằng liệu pháp hệ thống hay liệu pháp ánh sáng. Việc đồng thuận dựa trên kết quả của 3 thử nghiệm lâm sàng quốc tế, đa trung tâm (NCT01225731, NCT01722331 và NCT01729754) với sự tham gia của 1060 bệnh nhân vảy nến mảng vừa và nặng.
Tildrakizumab được điều chế dưới dạng tiêm dưới da với hàm lượng 100mg/ml và đựng trong các ống tiêm dùng 1 lần hay ống tiêm dùng lại. Hướng dẫn kê toa của Tildrakizumab cho thấy liệu trình dùng thuốc gồm 1 liều tại các tuần 0, tuần 4 và mỗi 12 tuần kế tiếp.
Tài liệu này cũng cảnh báo về sự xuất hiện của các phản ứng quá mẫn có thể xảy ra như mề đay và phù mạch, về việc tăng nguy cơ nhiễm trùng, khuyến nghị nên kiểm tra lao và điều trị nếu cần trước khi khởi động thuốc.

Trong các thử nghiệm ngẫu nhiên, đa trung tâm, mù đôi, có nhóm chứng giả dược nêu trên (reSURFACE 1 [ClinicalTrials.gov Identifier: NCT01722331] và reSURFACE 2 [ClinicalTrials.gov Identifier: NCT01729754]), những người dùng Tildrakizumab 100mg đạt được tỉ lệ sạch sang thương ở tuần 12 (kết quả 2 thử nghiệm lần lượt là PASI 75: 64% và 61%, PASI 90: 35% và 39%, và PASI 100: 14% và 12%) cao hơn những người dùng giả dược (kết quả 2 thử nghiệm lần lượt là PASI 75: 6% ở cả 2 thử nghiệm, PASI 90: 3% và 1%, PASI 100: 1% và 0%).
Hơn một nửa người dùng Tildrakizumab đạt được mốc điểm 0 và 1 của điểm PGA, trong khi ở nhóm dùng giả dược, tỉ lệ này chỉ đạt mức 7% và 4% ở 2 thử nghiệm.
Risankizumab
Risankizumab là thuốc ức chế IL-23 mới nhất được FDA đồng thuận để sử dụng trong điều trị vảy nến mảng. Risankizumab là kháng thể IgG1 đơn dòng nhân bản từ người, hoạt động bằng cách bám vào tiểu đơn vị p19 của IL-23, từ đó ức chế hoạt động tiền viêm của IL-23.
Vào năm 2019, Risankizumab được chấp thuận dùng trong điều trị vảy nến mảng vừa và nặng ở những người phải điều trị bằng liệu pháp hệ thống hay liệu pháp ánh sáng. Sự đồng thuận của FDA dựa trên kết quả của 5 thử nghiệm lâm sàng trên 1606 bệnh nhân vảy nến mảng vừa và nặng.
Thử nghiệm UltIMMa-1 (ClinicalTrials.gov Identifier: NCT02684370) và UltIMMa-2 (ClinicalTrials.gov Identifier: NCT02684357) so sánh độ an toàn và tính hiệu quả giữa Risankizumab, Ustekinumab và giả dược trong điều trị vảy nến mảng vừa và nặng. Ở thử nghiệm UltlMMa-2, 74,8% bệnh nhân điều trị bằng Risankizumab đạt PASI 90, trong khi con số này chỉ ở mức 2% với nhóm giả dược và 47,5% ở nhóm dùng Ustekinumab.
Tương tự, trong thử nghiệm UltlMMa-1, ở tuần thứ 16, 75,3% bệnh nhân dùng Risankizumab đạt đáp ứng PASI 90 trong khi nhóm giả dược chỉ 4,8% người đạt và con số này ở nhóm dùng Ustenkinumab là 42%. Ngoài ra, cũng trong thử nghiệm này, 87,8% bệnh nhân đạt được điểm PGA tĩnh ở mức 0 và 1. Kết quả này ở nhóm dùng giả dược và Ustekinumab lần lượt là 7,8% và 63%.
Risankizumab được điều chế dưới dạng tiêm dưới da với hàm lượng 150mg (2 ống tiêm 75mg), tiêm vào thời điểm tuần 0, 4 và mỗi 12 tuần sau đó. Hướng dẫn kê toa khuyến nghị các bác sĩ nên đánh giá tình trạng nhiễm lao trước khi khởi động điều trị và cũng cảnh báo rằng thuốc có thể làm tăng nguy cơ nhiễm khuẩn.
Trong thử nghiệm lâm sàng, các bệnh nhân điều trị bằng Risankizumab có tỉ lệ nhiễm khuẩn cao hơn những người dùng giả dược (22,1% so với 14,7%) nhưng tỉ lệ nhiễm trùng nặng vẫn ở mức thấp ở cả 2 nhóm (≤0,4%).
Hơn nữa, mặc dù các nghiên cứu trước đây đã chứng minh được rằng việc thay thế các thuốc sinh học có cùng 1 đích tác động cho nhau khi điều trị vảy nến có thể đem lại hiệu quả nhưng việc thay đổi các loại thuốc ức chế IL-23 khác nhau khi 1 thuốc không hiệu quả vẫn chưa được chứng minh là có thể mang lại hiệu quả điều trị.
Kết quả một nghiên cứu quan sát hồi cứu gần đây cho thấy các bệnh nhân vảy nến vừa và nặng điều trị bằng Risankizumab sau khi thất bại với Guselkumab có cải thiện tương tự như những người chỉ điều trị duy nhất bởi Risankizumab. Mức độ của bệnh vảy nến được đánh giá bằng con số tạo thành bằng việc nhân điểm PGA và BSA (PGA*BSA).
Kết quả cho thấy các bệnh nhân chuyển từ Guselkumab sang Risankizumab sau điều trị có điểm PGA*BSA giảm trung bình 79,3%. Những người chưa bao giờ điều trị bằng thuốc ức chế IL-23 có điểm PGA*BSA giảm 84,3% sau khi điều trị.
TS Fernandez khẳng định “Không cần bàn cãi, đây là những loại thuốc rất tốt. Các dữ liệu trong các thử nghiệm lâm sàng về tính hiệu quả cũng như độ an toàn đều cho thấy chúng rất tốt”. Ông nghĩ ở phòng khám nên chỉ định loại thuốc này cho những bệnh nhân có vảy nến vừa và nặng nhưng không kèm vảy nến khớp. Mặc dù vậy, Guselkumab cũng đã được FDA chấp thuận trong điều trị vảy nến khớp nên đối tượng dùng các thuốc ức chế IL-23 có thể sẽ được mở rộng trong vài năm kế tiếp.
Ông kết luận rằng “Tôi nghĩ các thuốc này đã có mặt trên thị trường đủ lâu để các bác sĩ có thể tự tin dùng chúng là thuốc điều trị đầu tay.”


