Biến dạng do sẹo và rối loạn sắc tố gây ra do bệnh lupus ban đỏ dạng đĩa (DLE) có thể gây tàn phá nặng nề.
Nền tảng của liệu pháp điều trị lupus ban đỏ ở da (CLE) là steroid (tại chỗ, tiêm trong da, toàn thân) và thuốc kháng sốt rét (hydroxychloroquine, chloroquine, quinacrine).
Các lựa chọn thứ 2 bao gồm thuốc ức chế miễn dịch (methotrexate, mycophenolate mofetil, azathioprine, những thuốc khác), thuốc điều hòa miễn dịch khác (thalidomide, lenalidomide), retinoids (acitretin, tazarotene tại chỗ), thuốc điều hòa miễn dịch tại chỗ (tacrolimus) và chống nắng.

Phân loại hiện tại của lupus ban đỏ ở da
Phân loại hiện tại của CLE bao gồm LE da cấp tính (ACLE), LE bán cấp (SCLE), LE da mạn tính (DLE, LE panniculitis và LE chilblain), LE không liên tục (Lupus tumidus) và LE sơ sinh.
(1) DLE là biến thể phổ biến nhất. Bệnh nhân mắc CLE có thể tiến triển thành LE toàn thân (SLE), cần được theo dõi định kỳ bằng cách xem xét các hệ thống và xét nghiệm trong phòng thí nghiệm (kháng thể kháng nhân, số lượng tế bào máu đầy đủ, xét nghiệm chuyển hóa và phân tích nước tiểu).
(2) Những hiểu biết sâu sắc về cơ chế bệnh sinh của bệnh lupus đã khuyến khích các thử nghiệm về các thuốc mới có thể cung cấp các lựa chọn hữu ích cho những bệnh nhân bị CLE không tuân theo các liệu pháp hiện có.
Theo Blake và Daniel: “LE do rối loạn chức năng bên trong hệ thống miễn dịch thích ứng và bẩm sinh, bắt đầu bằng việc mất khả năng tự chịu đựng trong hệ thống miễn dịch thích ứng thông qua việc sản xuất các tự kháng thể.
Các kháng thể này phản ứng một cách không thích hợp với các tự kháng nguyên có trong các mảnh vụn tế bào sau quá trình apoptosis, dẫn đến việc kích hoạt và tuyển dụng các tế bào T và B và tạo ra các phức hợp miễn dịch, gây tổn thương mô trực tiếp.
Một số con đường tín hiệu tiền viêm được điều chỉnh ở bệnh nhân LE, dẫn đến tăng hoạt động của cytokine.
Hệ thống miễn dịch và bổ thể bẩm sinh cũng đóng vai trò quan trọng sinh lý bệnh, nhận biết các kháng nguyên ngoại lai và loại bỏ các tế bào apoptotic. Sự trục trặc trong hai hệ thống này càng làm tăng thêm các biểu hiện LE ”.
Miễn dịch đóng vai trò quan trọng trong sinh lý bệnh
(3) Sự phát triển của CLE có khả năng bắt đầu trong lớp biểu bì tiền viêm, được điều hòa bởi sự sản xuất dư thừa interferon loại I (IFN) sau khi tiếp xúc với tia cực tím.
(4) Các yếu tố phiên mã kẽm Ikaros và Aiolos có liên quan đến khuynh hướng di truyền đối với SLE. Ikaros gây ra sự phát triển của tế bào B và tế bào đuôi gai plasmacytoid (pDCs, sản xuất chính của interferon loại I). Aiolos hỗ trợ biệt hóa tế bào B.
(5) Anifrolumab là một kháng thể đơn dòng IgG1K của người, liên kết với thụ thể interferon loại 1, do đó ngăn chặn tín hiệu interferon loại 1. Anifrolimumab đã được Cơ quan Quản lý Thực – Dược phẩm Hoa Kỳ (FDA) chấp thuận cho SLE (mặc dù không có viêm thận lupus) vào tháng 7 năm 2021.
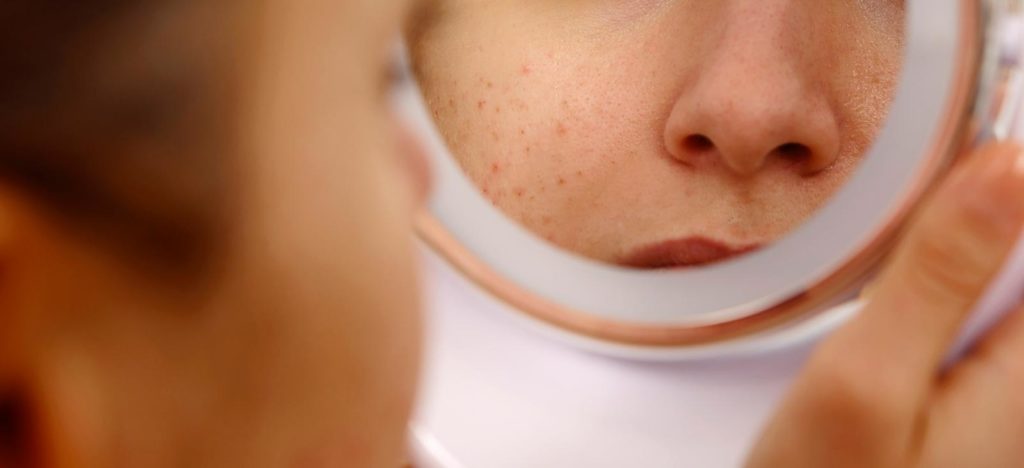
(6) Blum và cộng sự đã xác định được 3 bệnh nhân (phụ nữ da đen, từ 22 đến 51 tuổi) mắc CLE tái nghiện với các liệu pháp tiêu chuẩn (có thể khác nhau – thuốc chống sốt rét, thuốc ức chế miễn dịch, prednisone, rituximab, belimumab).
Tất cả các trường hợp đều cho thấy sự cải thiện đáng kể về sự xuất hiện của bệnh, sang thương của da và triệu chứng sau khi điều trị với 2 tháng truyền anifrolumab được thêm vào phác đồ của họ.
(7) Các thử nghiệm có đối chứng được bảo đảm để nghiên cứu tiềm năng của anifrolumab đối với CLE.
Nghiên cứu giai đoạn 2 sử dụng litifilimab
Kháng nguyên tế bào đuôi gai trong máu 2 (BDCA2) là một thụ thể biểu hiện độc quyền trên pDCs, sản xuất chính của INF loại I. Werth và cộng sự đã thực hiện một nghiên cứu giai đoạn 2 sử dụng litifilimab, một kháng thể đơn dòng được nhân bản hóa chống lại BDCA2, để xác định hiệu quả của nó trong việc giảm hoạt động của bệnh CLE.
Các tác giả đã chỉ định ngẫu nhiên những người trưởng thành mắc bệnh CLE đã được xác nhận về mặt mô học, có hoặc không có SLE, theo tỷ lệ 1: 1: 1: 1 để nhận litifilimab tiêm dưới da (với liều 50, 150 hoặc 450 mg) hoặc giả dược ở tuần 0, 2, 4, 8 và 12.
Họ sử dụng mô hình liều lượng – phản ứng để đánh giá liệu có phản ứng giữa bốn nhóm trên cơ sở điểm kết thúc chính, là phần trăm thay đổi từ ban đầu đến 16 tuần trong Bệnh Lupus đỏ ở da.
Chỉ số đỏ da và Mức độ nghiêm trọng – Điểm hoạt động (CLASI-A; điểm nằm trong khoảng từ 0 đến 70, với điểm số cao hơn cho thấy tình trạng da lan rộng hoặc nghiêm trọng hơn).
Sự an toàn cũng đã được đánh giá
Trong tổng số 132 người tham gia, 26 người được chỉ định cho nhóm litifilimab 50 mg, 25 người cho nhóm litifilimab 150 mg, 48 người cho nhóm litifilimab 450 mg, và 33 người cho nhóm giả dược. Điểm CLASI-A trung bình cho các nhóm tại cơ sở lần lượt là 15,2, 18,4, 16,5 và 16,5.
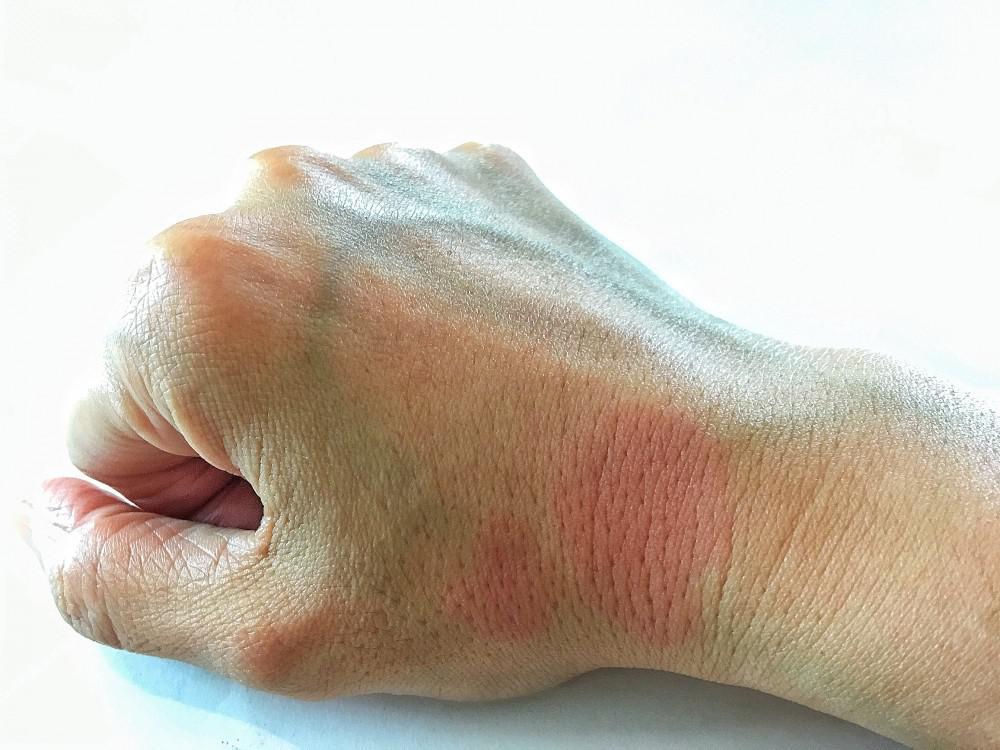
Sự khác biệt so với giả dược về sự thay đổi so với ban đầu trong điểm CLASI-A là đáng kể – ở tuần 16 là −24,3 điểm phần trăm ở nhóm 50 mg litifilimab, −33,4 điểm phần trăm ở nhóm 150 mg và −28,0 điểm phần trăm ở nhóm 450 mg. Litifilimab liên quan đến 3 trường hợp quá mẫn và nhiễm herpes miệng và một trường hợp nhiễm herpes zoster.
Một trường hợp viêm màng não do herpes zoster xảy ra 4 tháng sau khi người tham gia nhận được liều litifilimab cuối cùng.
Các tác giả kết luận rằng mặc dù litifilimab vượt trội hơn so với giả dược về phương pháp đo lường hoạt động của bệnh da trong thời gian 16 tuần, nhưng cần có các thử nghiệm lớn hơn và dài hơn để xác định tác dụng và độ an toàn của litifilimab trong điều trị CLE.
(8) Sprow và cộng sự nêu rõ: “IKZF1 và IKZF3 là các loci nhạy cảm với SLE và mã hóa các yếu tố phiên mã Ikaros và Ailos. Cereblon là một phân tử tạo thành một phần của phức hợp ubiquitin ligase làm trung gian cho quá trình polyubiquiti hóa và sự phân hủy phụ thuộc proteasome của Ikaros và Ailos.
Thalidomide và lenalidomide, những loại thuốc được sử dụng để điều trị CLE không kê toa, liên kết với cereblon, dẫn đến tăng phá hủy Ikaros và Ailos, dẫn đến giảm tế bào B, pDC và tăng tế bào điều hòa T. “
(6) Trong một thử nghiệm kéo dài 24 tuần, giai đoạn 2 liên quan đến bệnh nhân bị SLE, iberdomide (một bộ điều biến tế bào não thúc đẩy sự suy thoái của các yếu tố phiên mã Ikaros và Aiolos) đã dẫn đến tỷ lệ phần trăm bệnh nhân có phản ứng chỉ số SLE Responder-4 cao hơn so với giả dược. CLASI-A là điểm đến thứ 2 của nghiên cứu này; bệnh nhân mắc CLE có nhiều khả năng bị giảm điểm CLASI-A hơn với iberdomide.
(5). Các nghiên cứu trong tương lai được đảm bảo ở những bệnh nhân mắc CLE.
Mặc dù chúng ta đã biết rằng interferon đóng một vai trò chính trong cơ chế bệnh sinh của bệnh lupus, nhưng hiểu biết của chúng ta vẫn chưa đầy đủ. Khi sự hiểu biết của chúng ta về vai trò gây bệnh chính xác của interferon trở nên tinh vi hơn, thì các phương pháp điều trị can thiệp vào tác dụng của interferon cũng vậy.
Điểm cần nhớ: Những tiến bộ trong kiến thức về vai trò của interferon trong bệnh sinh lupus đang mang lại hứa hẹn điều trị.
Quan điểm của chuyên gia
Victoria P. Werth, MD, FAAD
Giáo sư Da liễu và Y khoa, Trường Y Đại học Pennsylvania
Trưởng khoa Da liễu, Bệnh viện Quản lý Cựu chiến binh Philadelphia
Đây là thời điểm thú vị đối với bệnh lupus ban đỏ ở da (CLE). Những phát hiện được công bố gần đây từ ba thử nghiệm lâm sàng cho thấy tiến bộ đáng kể trong việc phát triển các loại thuốc nhắm trúng đích, hiệu quả và dung nạp tốt hơn cho bệnh nhân CLE, đặc biệt bằng cách ức chế sản xuất hoặc hoạt động của interferon loại I ở vùng da bị ảnh hưởng.
NEJM vừa báo cáo một thử nghiệm giai đoạn 2 cho thấy litifilimab, một kháng thể đơn dòng được nhân bản hóa chống lại BDCA2, một thụ thể được tìm thấy trên tế bào đuôi gai plasmacytoid (pDCs), cải thiện đáng kể sự tham gia của da ở bệnh nhân CLE, có hoặc không đồng thời LE toàn thân (SLE).
(8) Litifilimab gây ra sự nội hóa của thụ thể BDCA2 và do đó ức chế sản xuất cục bộ các cytokine và chemokine gây viêm, đặc biệt là các interferon loại I. Một nghiên cứu giai đoạn 1 gần đây kiểm tra dadilimab, một kháng thể đơn dòng được nhân bản hóa làm cạn kiệt pDCs, cho thấy sự ức chế các phản ứng interferon loại I ở da – cũng như cải thiện đáng kể hoạt động của bệnh CLE.
(9) Anifrolumab là một kháng thể chống lại thụ thể interferon loại I, do đó ngăn chặn nhiều interferon loại I liên kết và kích hoạt thụ thể interferon-α / β (IFNAR). FDA (Hoa Kỳ) gần đây đã phê duyệt anifrolumab cho SLE, dựa trên thử nghiệm giai đoạn 3 cho thấy các triệu chứng toàn thân được cải thiện, cũng như cải thiện bệnh da lupus ở bệnh nhân SLE.
(10) Bởi vì SLE là một tập hợp các tiêu chuẩn, sự chấp thuận theo quy định không mở rộng cho những bệnh nhân mắc CLE không mắc đồng thời SLE. Các thử nghiệm lâm sàng của ba tác nhân mới này đưa ra một thông điệp nhất quán – cụ thể là việc nhắm mục tiêu vào các interferon loại I làm giảm hoạt động bệnh da ở nhiều bệnh nhân có phát hiện LE trên da.
Cả ba thử nghiệm này đều sử dụng một công cụ mức độ nghiêm trọng của bệnh đã được xác thực, chỉ số mức độ và diện tích lupus ban đỏ trên da (CLASI), ghi lại những thay đổi trên da có ý nghĩa đối với chất lượng cuộc sống của bệnh nhân, bao gồm độ phân giải toàn bộ và độ phân giải một phần có ý nghĩa.
(11) Lưu ý, FDA thường cho phép phê duyệt theo quy định đối với các loại thuốc mới tạo ra những cải thiện một phần có ý nghĩa trong nhiều bệnh, nhưng cơ quan này thường yêu cầu xóa bỏ hoàn toàn hoặc gần như hoàn toàn các tổn thương da trước khi phê duyệt các loại thuốc điều trị da liễu mới.
Cách tiếp cận theo quy định như vậy có thể cản trở sự tiến bộ trong CLE, trong đó những cải thiện một phần thường có ý nghĩa đối với bệnh nhân. Hơn nữa, hiện chỉ có hai loại thuốc được FDA chấp thuận cho CLE, hydroxychloroquine và glucocorticoid, cả hai đều đã được sử dụng từ trước năm 1962, khi FDA công bố chúng mà không có thử nghiệm lâm sàng.
Các vấn đề cần nghiên cứu thêm bao gồm sự không đồng nhất của các đáp ứng, vì không phải tất cả bệnh nhân mắc CLE trong ba thử nghiệm gần đây đều được cải thiện, cũng như các cơ chế chính xác mà các thao tác điều trị của tế bào đuôi gai plasmacytoid trong hai thử nghiệm đều phát huy tác dụng có lợi.
Ngoài interferon loại I và pDC, có nhiều liệu pháp nhắm mục tiêu khác đang được phát triển cho CLE. Chúng tôi hy vọng những phát hiện của bài báo NEJM và các nghiên cứu mới khác sẽ cho phép phát triển các loại thuốc có hiệu quả hơn và ít tác dụng phụ hơn trong CLE so với những loại thuốc hiện đang được sử dụng.
Tài liệu tham khảo:
- Bitar C, Menge TD, Chan MP. Cutaneous manifestations of lupus erythematosus: a practical clinicopathological review for pathologists. Histopathology. 2022 Jan;80(1):233-250. doi: 10.1111/his.14440. PMID: 34197657.
- Heymann WR. The criteria-dependent risk of systemic lupus erythematosus developing in patients with discoid lupus erythematosus. J Am Acad Dermatol. 2022 Jul 8:S0190-9622(22)02259-9. doi: 10.1016/j.jaad.2022.07.005. Epub ahead of print. PMID: 35810838.
- Blake SC, Daniel BS. Cutaneous lupus erythematosus: A review of the literature. Int J Womens Dermatol. 2019 Jul 31;5(5):320-329. doi: 10.1016/j.ijwd.2019.07.004. PMID: 31909151; PMCID: PMC6938925.
- Maz MP, Martens JWS, Hannoudi A, Reddy AL, Hile GA, Kahlenberg JM. Recent advances in cutaneous lupus. J Autoimmun. 2022 Jul 17:102865. doi: 10.1016/j.jaut.2022.102865. Epub ahead of print. PMID: 35858957.
- Merrill JT, Werth VP, Furie R, van Vollenhoven R, Dörner T, Petronijevic M, Velasco J, Majdan M, Irazoque-Palazuelos F, Weiswasser M, Korish S, Ye Y, Gaudy A, Schafer PH, Liu Z, Agafonova N, Delev N. Phase 2 Trial of Iberdomide in Systemic Lupus Erythematosus. N Engl J Med. 2022 Mar 17;386(11):1034-1045. doi: 10.1056/NEJMoa2106535. PMID: 35294813.
- Sprow G, Dan J, Merola JF, Werth VP. Emerging Therapies in Cutaneous Lupus Erythematosus. Front Med (Lausanne). 2022 Jul 11;9:968323. doi: 10.3389/fmed.2022.968323. PMID: 35899214; PMCID: PMC9313535.
- Blum FR, Sampath AJ, Foulke GT. Anifrolumab for Treatment of Refractory Cutaneous Lupus Erythematosus. Clin Exp Dermatol. 2022 Jul 17. doi: 10.1111/ced.15335. Epub ahead of print. PMID: 35844070.
- Werth VP, Furie RA, Romero-Diaz J, Navarra S, Kalunian K, van Vollenhoven RF, Nyberg F, Kaffenberger B, Sheikh SZ, Radunovic G, Huang X, Carroll H, Gaudreault F, Meyers A, Barbey C, Musselli C, Franchimont N, for the LILAC Study investigators. Trial of anti-BDCA2 antibody litifilimab for cutaneous lupus erythematosus. N Engl J Med. 287:321-331, 2022 (July 28). doi: 10.1056/NEJMoa2118024
- Karnell JL, Wu Y, Mittereder N, Smith MA, Gunsior M, Yan L, Casey KA, Henault J, Riggs JM, Nicholson SM, Sanjuan MA, Vousden KA, Werth VP, Drappa J, Illei GG, Rees WA, Ratchford JN, for the VIB7734 Trial Investigators. Depleting plasmacytoid dendritic cells reduces local type I interferon responses and disease activity in patients with cutaneous lupus. Sci Transl Med. 2021;13:eabf8442. doi: 10.1126/scitranslmed.abf8442
- Morand EF, Furie R, Tanaka Y, Bruce IN, Askanase AD, Richez C, et al. Trial of anifrolumab in active systemic lupus erythematosus. N Engl J Med. (2020) 382:211-21. doi: 10.1056/NEJMoa1912196
- Chakka S, Krain RL, Ahmed S, Concha JSS, Feng R, Merrill JT, Werth VP. Evaluating change in disease activity needed to reflect meaningful improvement in quality of life for clinical trials in cutaneous lupus erythematosus. J Am Acad Dermatol 84(6):1562-1567, 2021.


